解锁mRNA疗法潜力的四大要素
2025-01-09 17:35:28在mRNA疫苗取得巨大成功之后,利用mRNA表达具有治疗作用的蛋白,开发mRNA疗法成为这一领域的下一个目标。然而,将mRNA转化为一种新治疗模式,造福罕见和常见病患者,仍然面临着一系列挑战。不过,科学家们正在开发一系列创新技术,系统性地解决这些挑战。日前,Nature Biotechnology上发表的一篇深度综述对解锁mRNA疗法潜力的四大要素进行了分析。
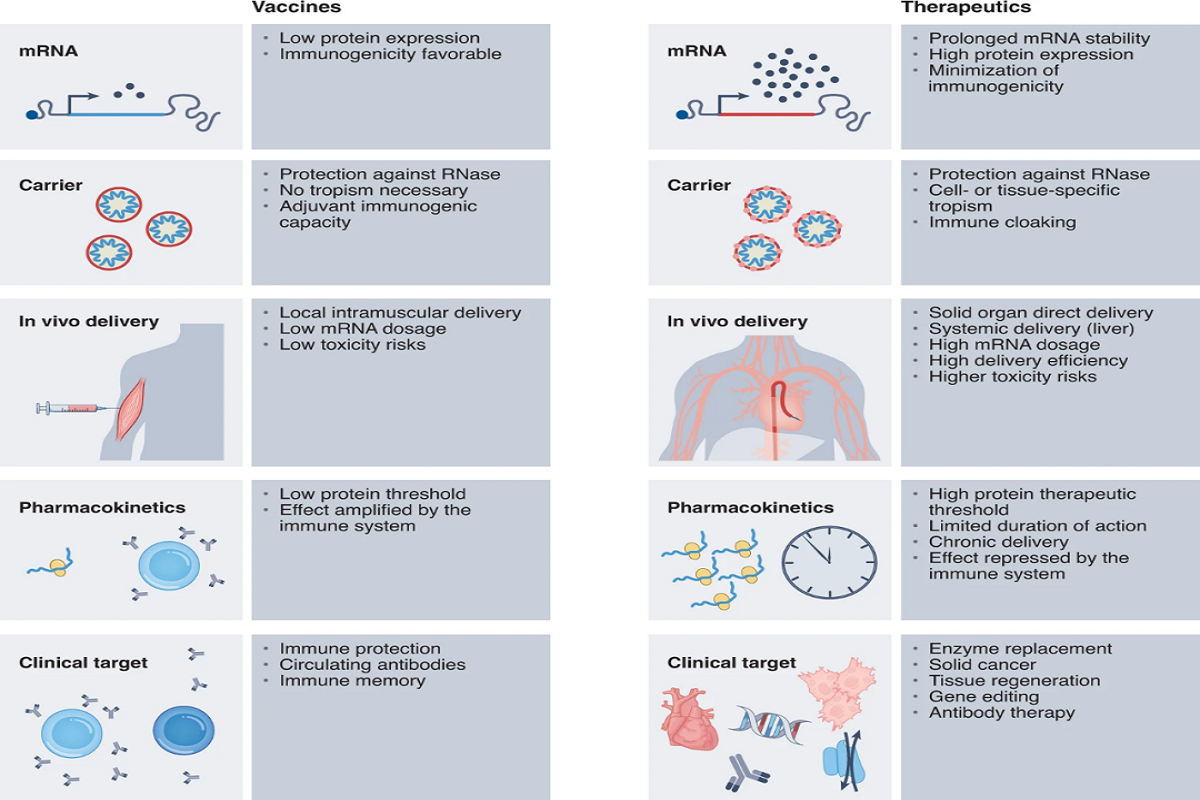
开发mRNA疗法与mRNA疫苗的不同之处
开发mRNA疗法与mRNA疫苗相比,需要克服额外的一系列挑战。因为,mRNA疫苗需要生产的蛋白水平很低,人体的免疫系统会通过细胞和抗体介导的免疫反应放大免疫信号。而mRNA疗法需要产生的蛋白水平可能需要达到mRNA疫苗的1000倍才能产生治疗效果。
很多情况下,mRNA疗法产生的蛋白需要与特定器官、组织或细胞中的信号通路发生相互作用,这意味着靶标细胞对疗法的吸收将决定蛋白表达水平和疗法的持久性。组织生物可利用度、血循环中的半衰期以及载体的靶向递送效率都可能成为限速因素。向肝脏以外的组织精准递送mRNA疗法仍然是一个挑战。
mRNA疗法的另一个挑战是重复给药。即使对mRNA进行了化学修饰优化并通过脂质纳米颗粒(LNP)递送,长期给药最终仍然会激发先天免疫反应,从而导致蛋白表达水平下降。
增强蛋白表达水平的不同策略
mRNA的内在免疫原性虽然会增强其作为疫苗的效力,但是反而会阻碍它们作为疗法的效力。在小鼠模型中,mRNA作为酶替代疗法(ERT),通常需要比mRNA疫苗高50~1000倍的剂量才能获得治疗水平的蛋白表达。目前,科学家们正在使用多种策略优化mRNA疗法的设计,达到维持高水平蛋白表达的目的。这些策略包括:
对mRNA序列的优化
mRNA序列通常包括5’端帽(cap)、5’和3’端的非转录序列(UTR)、开放阅读框(ORF)和多聚腺苷酸化尾(poly-A tail)。每一个部分都可以通过优化来提高蛋白表达水平或mRNA的稳定性。优化mRNA序列方面最重要的突破之一是利用化学修饰的核苷来取代天然的核苷(特别是尿苷),这一技术可以显著降低mRNA被先天免疫系统识别的可能,提高了蛋白的表达水平。在这方面做出突出贡献的Katalin Karikó与Drew Weissman博士也在2021年获得拉斯克临床医学研究奖。由于mRNA序列中的尿苷比例对先天免疫反应有很大影响,即使不使用化学修饰的核苷,通过优化密码子,替换序列中的尿苷仍然能够获得降低免疫反应,提高蛋白表达的效果。
在蛋白表达水平高低之外,限制mRNA疗法的一个重要因素是蛋白生产的持续时间较短,这意味着需要反复给药。目前,增强蛋白表达持久性的策略包括以下几种:
自我扩增mRNA(samRNAs)基于RNA病毒的自我扩增机制,可以在细胞质中诱导samRNA序列的复制。这一技术可以延长mRNA疗法的表达动力学,从而降低给药的频率。与传统线性mRNA相比,samRNA能够在剂量降低约10倍的情况下维持相似的蛋白表达水平。
另一种策略为环形RNA(circRNA),这一技术消除了线形RNA被外切酶识别的两端,显著提高了mRNA的稳定性。环形RNA半衰期的延长让它们在不提高蛋白表达水平的情况下,增加蛋白的总产量。而且,环形RNA显著降低了mRNA被先天免疫系统识别的可能。
这些策略之外,mRNA的纯化对其表达水平也有重大的影响。mRNA的合成过程可能产生不想要的副产物,比如双链RNA,没有端帽的mRNA或者mRNA片段。这些副产物都可能严重干扰mRNA的转译,激活先天免疫系统,或者导致对mRNA活性的误判。研究显示,对化学修饰或未经修饰的mRNA的纯化,在小鼠模型中分别增加蛋白表达超过400%和30%,凸显了纯化步骤的重要性。